Vacina vai usar tecnologia semelhante à da CoronaVac e de vacinas contra a gripe. Expectativa é de início dos testes em abril.
O Instituto Butantan, em São Paulo, anunciou, nesta sexta-feira (26), que está desenvolvendo a Butanvac, nova candidata a vacina contra a Covid-19. A vacina é a primeira, contra qualquer doença, a ser desenvolvida completamente no Brasil.
Segundo o diretor do instituto, os testes da vacina no país poderão começar em abril. Veja as principais perguntas respondidas pelo Diretor do Instituto Butantan
- Por que a Butanvac é relevante? Faz sentido ter uma vacina só daqui a meses?
- Quando começarão os testes? Quem vai poder se candidatar?
- As previsões de conclusão dos estudos são realistas?
- Como será a vacina? Qual tecnologia ela vai usar?
- Quantas doses a vacina terá?
- A vacina será segura?
- A vacina vai funcionar contra as novas variantes?
- Como o Butantan irá organizar os testes em humanos, já que idosos já estão sendo vacinados? Há questões éticas envolvidas?
1. Por que a Butanvac é relevante? Faz sentido ter uma vacina só daqui a meses?
A pesquisadora Ester Sabino, da USP, que liderou a equipe a fazer o primeiro sequenciamento genético do coronavírus no Brasil, avalia que uma vacina nacional é importante justamente porque é necessário pensar a longo prazo no combate ao vírus – inclusive para futuras epidemias.
“É muito importante ter uma vacina nacional porque o problema ainda não acabou e, para o coronavírus, vai ser necessário pensar a longo prazo”, explica.
“Nos últimos 20 anos, este é o terceiro coronavírus que entra na espécie humana”, lembra Sabino. “Tudo indica que podem acontecer outras transmissões, e a gente precisa estar preparado para responder a essas novas epidemias que virão. Temos que começar agora desenvolvendo novas vacinas que, se não forem usadas nessa pandemia, serão usadas nos problemas que certamente virão no futuro”.
O infectologista Leonardo Waissmman, da Sociedade Brasileira de Infectologia (SBI), destaca que, com uma vacina totalmente nacional, o Brasil não dependerá de importação de matéria-prima, conhecida como Ingrediente Farmacêutico Ativo (IFA). O IFA utilizado nas vacinas que estão sendo testadas e aplicadas no Brasil até o momento são importados da China.
“Toda tecnologia nova e brasileira é bem vinda, principalmente quando se trata de tecnologia nova de imunizantes, como no caso do coronavírus. A Butanvac vai usar matéria-prima brasileira e utilizar tecnologia semelhante à da vacina contra a gripe, que já é produzida pelo próprio Butantan. É diferente de dependermos de insumos de fora do Brasil”, avalia.
Waissmman lembra, ainda, que não temos vacinas suficientes no país e que a Butanvac já considera a variante identificada pela primeira vez em Manaus.
“[A Butanvac] tem relevância, principalmente porque as vacinas que estão no país ainda estão em quantidade escassa. Por estar sendo produzida nacionalmente, essa vacina também considera nossa realidade”.
Kfouri também avalia que o desenvolvimento de uma vacina em solo brasileiro é positiva.
“Eu acho que nós termos na cesta de opções mais uma vacina 100% nacional, mais uma vacina que nos dá independência, é muito bom. Então, se nós conseguirmos ter 3 vacinas produzidas aqui no Brasil, de diferentes tecnologias, sermos exportadores de vacinas é um grande avanço para a nossa ciência”, destaca.
Tanto a CoronaVac e a vacina de Oxford, aplicadas hoje no país, têm acordos de transferência de tecnologia para serem produzidas no Brasil. Nenhuma das duas, entretanto, foi desenvolvida no país, como a Butanvac.
2. Quando começarão os testes? Quem vai poder se candidatar?
O diretor do Butantan, Dimas Covas, afirmou que vai entregar o dossiê da vacina à Agência Nacional de Vigilância Sanitária (Anvisa) nesta sexta (26). Segundo ele, se a agência autorizar, os testes, de fase 1 e 2 simultâneas, podem começar em abril.
Ainda não está totalmente claro quem vai poder participar. De acordo com o Butantan, os voluntários provavelmente terão que ter no mínimo 18 anos e não poderão ser de grupos prioritários.
Renato Kfouri, diretor da SBIm, avalia que, pelo menos nos testes iniciais, os participantes deverão ser pessoas jovens e que não foram vacinadas e nem tiveram Covid – ou seja, que não têm anticorpos contra o vírus.
Na fase 1 de testes de uma vacina, os cientistas testam a segurança e eficácia de uma vacina em fase inicial, normalmente com dezenas de voluntários. Na fase 2, os testes são feitos com mais voluntários – geralmente, centenas. Na fase 3, a última, são milhares de participantes.
Na pandemia, por causa da urgência em achar uma vacina, algumas delas têm sido testadas em fases simultâneas, isto é, em fases 1 e 2 ou 2 e 3 ao mesmo tempo.
Fora do país, os testes de fase 1 já começaram.
No dia 15, as primeiras pessoas receberam a vacina em Hanói, no Vietnã. O parceiro brasileiro no país é o Instituto de Vacinas e Biologia Médica vietnamita.
O outro parceiro do Brasil é a Organização Farmacêutica Governamental da Tailândia. Lá, os testes em humanos devem ser iniciados em breve; até agora, Tailândia e Brasil só testaram a vacina em animais.
3. As previsões de conclusão dos estudos são realistas?
Para Renato Kfouri, apesar das previsões feitas pelo Butantan, ainda não é possível falar em data – e é preciso ter cautela.
“Prometer data a essa altura do campeonato, como a gente já falava no ano passado, quem promete data para entregar uma vacina que está em estudo é mais político do que cientista”, alerta.
“Iniciamos o estudo de uma vacina em humanos – como outras 70 vacinas que já começaram estudos em seres humanos – e com investimento em tecnologia brasileira, no parque nacional nosso de desenvolvimento. Realmente são ótimas notícias a comemorar, mas não podemos colocar o carro na frente dos bois”, explica.
Kfouri detalha as fases seguintes:
- os dados ainda precisam passar pela Anvisa e pelo Conselho Nacional de Ética em Pesquisa, que também precisa aprovar os ensaios em humanos;
- quando começarem, os ensaios ainda terão que verificar o ajuste de doses: qual a dose a ser dada, quantas, com que concentração e com que intervalo entre elas;
- os testes também vão avaliar, claro, a segurança e a eficácia da vacina: se ela estimula anticorpos protetores e com que dosagem esse estímulo foi obtido.
“Todos esses estudos terão que ser feitos para que possamos, depois de todas essas etapas cumpridas, iniciar os estudos de fase 3, que são aqueles que estamos mais acostumados a ver”, esclarece o infectologista.
4. Como será a vacina? Qual tecnologia ela vai usar?
A Butanvac será feita com as tecnologias de vírus inativado e de vetor viral.O modo de produção é semelhante ao da vacina da gripe que é produzida pelo Butantan – usando ovos no processo.
Entenda cada parte, explicada pelo diretor da Sociedade Brasileira de Imunizações (SBIm), Renato Kfouri:
- A plataforma de vírus inativado é a usada nas vacinas da gripe, que tomamos todos os anos, e na CoronaVac, desenvolvida pela chinesa Sinovac e que está sendo envasada no próprio Butantan. Nesse tipo de vacina, o vírus é colocado inteiro dentro dela (veja infográfico), mas não é capaz de causar a doença.

- Já a tecnologia de vetor viral é usada na vacina de Oxford – que, assim como a CoronaVac, está sendo aplicada no Brasil. Nesse tipo de vacina, um outro vírus, o vírus vetor, é modificado geneticamente para “carregar” uma parte do código genético do coronavírus dentro dele (veja infográfico).
- Nas vacinas de vetor viral, nenhum dos dois vírus tem o poder de causar doença. Nenhuma vacina contra o coronavírus pode causar a Covid-19.
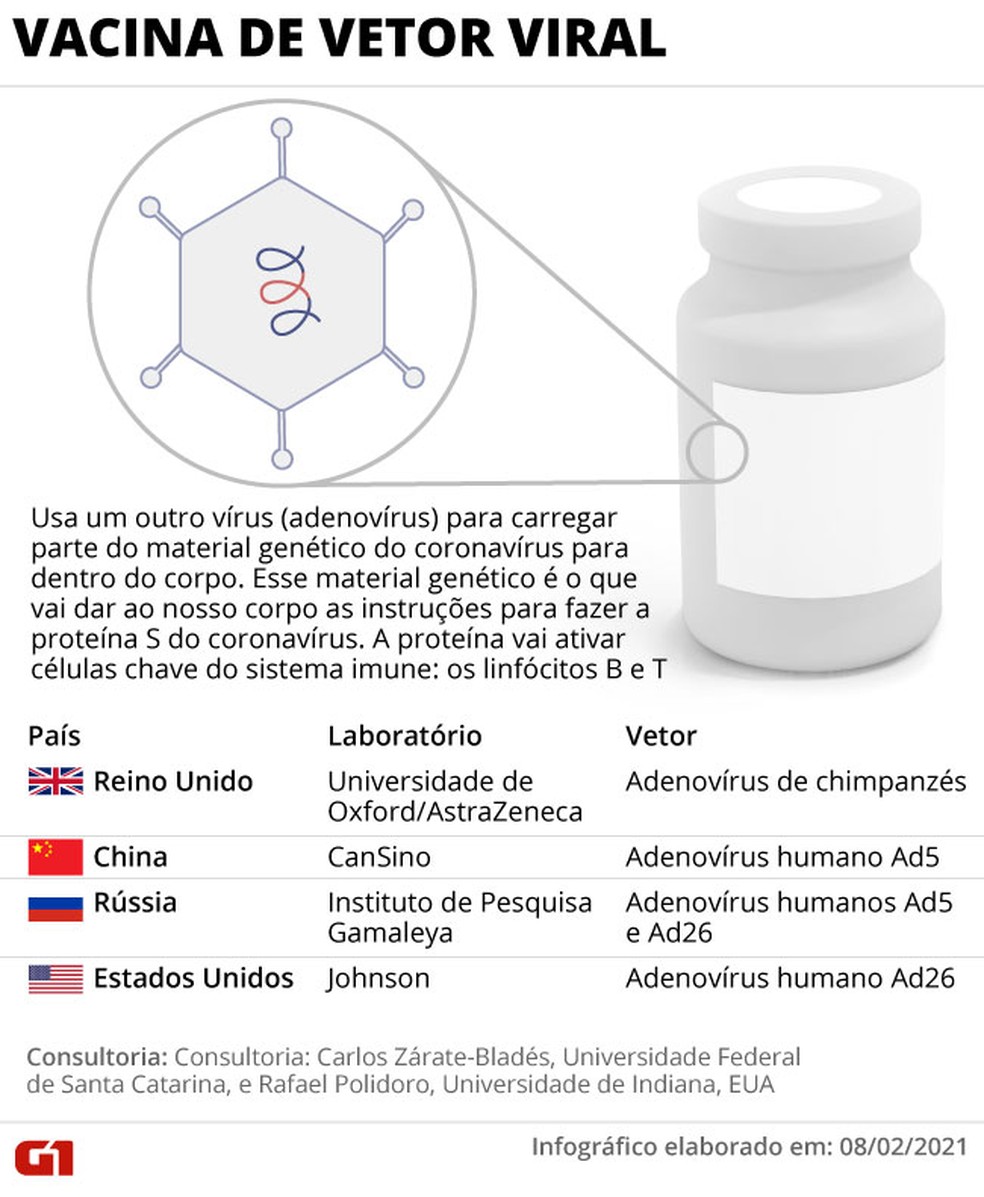
- A Butanvac vai usar as duas plataformas. Um outro vírus – o da doença de Newcastle, da família do sarampo, neste caso – vai ser modificado geneticamente para “carregar” um pedaço do coronavírus dentro dele. Esse vírus será o vetor.
- O pedaço do coronavírus que o vetor vai carregar é o código genético que dá as instruções de como fazer a proteína S. A proteína S é a que o vírus usa para infectar as nossas células.
- Esse vírus (da doença de Newcastle + pedaço do coronavírus) será colocado em ovos de galinha. No ovo, as células que estão ali vão “ler as instruções” para fabricar a proteína S e replicar o vírus: ou seja, vão produzi-lo em maior quantidade.
- O vírus precisa ser colocado no ovo porque ele não consegue se replicar sozinho, ele precisa das células.
- Quando houver vírus em grande quantidade dentro do ovo, esses vírus serão retirados dali, inativados e fragmentados.
- A proteína S será purificada e é o que vai para a vacina. Esse é o chamado ingrediente farmacêutico ativo (IFA). O que será injetado na pessoa é uma espécie de concentrado da proteína. O vírus de Newcastle não entra na composição da vacina.
A vacina contra a gripe é feita de forma semelhante a esse processo. A diferença é que, no caso da gripe, o vírus que é colocado dentro do ovo não tem vetor. Esse tipo de produção é seguro e de baixo custo.
“É uma ideia que existe em uma ou outra plataforma já de vacinas em desenvolvimento no mundo, mas que o Butantan sai na frente em termos de estudos em humanos”, explica Kfouri.
5. Quantas doses a vacina terá?
Os pesquisadores ainda não sabem. Existe a chance de que ela seja aplicada em apenas uma dose, mas isso ainda precisa ser testado.
Segundo o diretor do Butantan, Dimas Covas, a vacina é mais imunogênica do que as anteriores. Isso significa que ela tem capacidade de fazer o sistema de defesa do corpo criar defesas de forma mais eficiente contra o coronavírus. Por causa disso, é possível que seja dada em apenas uma dose, mas isso ainda não está determinado.
Hoje, as duas vacinas aplicadas no Brasil para a Covid-19 (CoronaVac e Oxford) são dadas em duas doses.
6. A vacina será segura?
Segundo o anúncio do Butantan, sim. O diretor do instituto, Dimas Covas, disse que o perfil de segurança da vacina é “excelente”. “É seguro e é uma tecnologia tradicional”, completou o diretor.
7. A vacina vai funcionar contra as novas variantes?
Também de acordo com o anúncio do Butantan, vai. A Butanvac já foi desenvolvida levando em consideração as novas variantes – inclusive a P.1, que foi detectada pela primeira vez em Manaus.
O diretor também afirmou que a vacina pode ser rapidamente adaptada para o caso de surgirem novas variantes do coronavírus.
Renato Kfouri, da SBIm, avalia que este parece ser o caso, mas que mais estudos ainda são necessários. Como a Butanvac usa o código genético do coronavírus, ela é, em teoria, potencialmente adaptável, diz.
“Essa é uma tecnologia nova, certamente não temos todas as respostas e provavelmente vamos aguardar um momento para tê-las, mas as vacinas mais adaptáveis às variações do vírus são justamente aquelas genéticas”, explica.
8. Como o Butantan irá organizar os testes em humanos, já que idosos já estão sendo vacinados? Há questões éticas envolvidas?
Sim, existem questões éticas. Kfouri aponta que, por exemplo, os grupos de controle nos testes com idosos devem desaparecer.
“Esse é um outro desafio das vacinas de segunda e terceira geração. Quando tivermos muitas pessoas vacinadas, talvez não seja ético fazermos estudos como a gente fez de fase 3 de eficácia com grupo placebo”, afirma.
Em ensaios clínicos, o chamado grupo placebo, ou grupo controle, recebe uma substância inativa, para que os cientistas possam medir a eficácia do remédio ou vacina testada. Desta forma, é possível comparar o efeito do medicamento em pessoas com perfis semelhantes – em crianças ou idosos, por exemplo.
Normalmente, isso é feito sem que os pesquisadores nem os participantes saibam quem recebeu o placebo e quem recebeu a vacina ou o remédio. Além disso, as pessoas são colocadas em cada grupo de forma aleatória. Esse tipo de ensaio clínico é chamado de duplo-cego e randomizado.
Só que, quando já existem vacinas que funcionam no mercado – como agora para a Covid-19 – vem o problema ético de não dar uma delas às pessoas dos testes e deixá-las sob o risco de contrair uma doença que pode ser fatal.
“Eu vou dar a vacina candidata para um grupo e não vou dar nada para o outro grupo, quando já existe vacina disponível?”, questiona Kfouri. “Por exemplo, estudos com grupo placebo em idosos vão desaparecer, porque nós não vamos mais poder incluir idosos se já temos vacina disponível para eles – não seria justo nem ético colocá-los num estudo quando já há vacinas disponíveis”, pontua.






